La società lombarda, focalizzata su ricerca, sviluppo, validazione clinica e produzione di innovative terapie geniche e cellulari, archivia un primo trimestre 2017 importante sotto il profilo degli accordi commerciali raggiunti con altre realtà, proseguendo così il percorso di sviluppo che ha caratterizzato il 2016.
- Riccardo Palmisano, CEO di MolMed, delinea le priorità strategiche
- Lo sviluppo della pipeline di prodotti proprietari
- La produzione conto terzi
- Un 2016 ricco di soddisfazioni: i traguardi dell’attività
- Un 2016 ricco di soddisfazioni: l’ottenimento di un finanziamento
- Un 2016 ricco di soddisfazioni: i servizi conto terzi
- Uno sguardo al 2017
- I conti del primo trimestre 2017
- Lo scenario dei prossimi 18-24 mesi
- Ricavi – Storico e prospettico in deciso progresso
- Ebitda – Atteso un forte miglioramento
- Ebit – Atteso in progresso in scia agli altri aggregati
- Analisti
- Borsa – L’ottima performance riflette l’apprezzamento dei traguardi raggiunti
- Criticità
MolMed si lascia alle spalle un primo trimestre 2017 caratterizzato dal raggiungimento di importanti traguardi, tra cui accordi di licenza e distribuzione in Israele e in alcuni paesi asiatici.
Il tutto in scia ai rilevanti risultati raggiunti nel corso del 2016, primo tra tutti l’Autorizzazione della Commissione Europea all’immissione condizionata in commercio (CMA) di Zalmoxis®.
Degni di nota anche il finanziamento di circa 6 milioni di euro per il progetto EURE-CART (EURopean Endeavour for Chimeric Antigen Receptor Therapies), di cui MolMed è coordinatore, e la presentazione dei primi dati pre-clinici del progetto CAR-CD44v6, che ne hanno confermato l’efficacia e la sicurezza nel trattamento dei tumori del sangue ma soprattutto ne hanno dimostrato la potenziale efficacia nei tumori solidi.
Traguardi, quelli di MolMed, particolarmente apprezzati dalla Borsa. Infatti nelle ultime 52 settimane il titolo ha segnato un rialzo di circa il 22%, sostanzialmente in linea con il relativo indice settoriale Ftse Italia Salute.
Riccardo Palmisano, CEO di MolMed, delinea le priorità strategiche
“Sviluppo della pipeline dei prodotti proprietari e produzione di servizi ad alto valore aggiunto condotta per conto terzi nell’ambito delle terapie geniche e cellulari”.
“Sono queste” afferma Riccardo Palmisano, CEO di MolMed “le priorità strategiche che rispecchiano i due pilastri su cui poggia la crescita della nostra società.”
E aggiunge “di conseguenza focalizzeremo le nostre attività da un lato sulla valorizzazione dei nostri prodotti, con accordi commerciali e di co-sviluppo, ma anche proseguendo nell’attività di ricerca e nell’ampliamento della pipeline, e dall’altro sulla firma di nuovi contratti di servizio conto terzi, nonché sul rafforzamento di quelli già in essere”.
Lo sviluppo della pipeline di prodotti proprietari
“In particolare, per quanto riguarda il primo e fondamentale pilastro di crescita”, riporta il numero uno dell’azienda, “ci concentreremo sulla valorizzazione dell’attuale portafoglio dei prodotti proprietari, soprattutto nell’ambito delle terapie cell&gene (Zalmoxis, CAR-CD44v6) e sull’ampliamento dello stesso, valorizzando la nostra eccellenza che sta nello sviluppo, industrializzazione e produzione di nuove terapie geniche e cellulari”.
Ricordiamo che Zalmoxis è una terapia, designata peraltro come “Farmaco Orfano”, basata sull’ingegnerizzazione del sistema immunitario ed impiegata in associazione al trapianto aplo-identico di cellule staminali ematopoietiche (haematopoietic stem-cell transplantation– HSCT), nei pazienti affetti da tumori del sangue di grado severo.
Il CAR-CD44v6 è invece una terapia inclusa nella famiglia dei linfociti T-CAR, ovvero linfociti T armati con recettori chimerici, dotati di un elevato potenziale antitumorale e in grado di contrastare tumori, quali neoplasie ematologiche particolarmente aggressive e resistenti alle terapie tradizionali.
La produzione conto terzi
“Per quanto riguarda invece la produzione”, prosegue il CEO, “il nostro obiettivo è portare a regime la nostra nuova facility che abbiamo finito di costruire nel 2016 e che ha cominciato a ricevere le prime autorizzazioni dalle autorità regolatorie: si tratta di un grande investimento che ha portato ad allestire ed attrezzare oltre 4.500 metri quadri di laboratori e aree produttive presso il parco scientifico Open Zone a Bresso”.
E sottolinea che “il grosso degli investimenti necessari per questa operazione è quindi ormai alle spalle, mentre oggi siamo impegnati nell’iter autorizzativo avviato formalmente a dicembre 2015. È stata già concessa l’autorizzazione delle aree Quality Control, stoccaggio materiali e stoccaggio prodotti a settembre 2016 (in seguito a ispezione AIFA avvenuta a giugno 2016), mentre l’area GMP Manufacturing è in avanzata fase di validazione e per una parte di essa è già stato avviato il processo autorizzativo a partire da giugno 2016”.
“Grazie al significativo ampliamento della capacità produttiva di cui potrà usufruire”, conclude Palmisano sull’argomento, “MolMed ritiene che potrà essere in grado di sostenere il trattamento dei pazienti con la terapia Zalmoxis, una volta che questa sarà commercializzata, nonché di soddisfare la domanda generata dagli accordi di partnership siglati con i propri partner”.
Un 2016 ricco di soddisfazioni: i traguardi dell’attività
“Il 2016” afferma Palmisano, “ha segnato per Molmed un anno di svolta in cui sono stati raggiunti importanti traguardi, primo tra tutti l’Autorizzazione della Commissione Europea all’immissione condizionata in commercio (CMA) per Zalmoxis.
Quest’ultima rappresenta la prima terapia cellulare paziente-specifica sviluppata da MolMed che, impiegata in associazione al trapianto aplo-identico di cellule staminali ematopoietiche in pazienti adulti affetti da tumori del sangue ad alto rischio, aumenta significativamente la sopravvivenza a lungo termine, indipendentemente dalle condizioni del paziente al momento del trapianto. In assenza di un donatore compatibile, Zalmoxis rende quindi il trapianto aploidentico più sicuro ed efficace, ampliando così la possibilità di ricorrervi e di conseguenza aiutando a colmare un importante bisogno medico insoddisfatto all’interno di una procedura sempre più utilizzata dagli ematologi.
“Zalmoxis”, sottolinea Palmisano, “ha indubbiamente rappresentato una conferma dell’eccellenza dell’attività di ricerca, sviluppo e produzione di MolMed, ma anche una reale svolta dando il via alle interazioni con le autorità̀ sanitarie nazionali per l’accesso ai singoli mercati europei. Inoltre, abbiamo intensificato le attività finalizzate alla definizione di accordi di licenza con partner internazionali, tra cui TTY e Megapharm, con i quali sono stati firmati i primi contratti di collaborazione commerciale, in attesa di identificare il partner ideale per la commercializzazione nei paesi dell’Unione Europea”. 
Un secondo importante traguardo raggiunto nel 2016 è rappresentato dal progetto CAR-CD44v6. “A dicembre 2016”, ricorda Palmisano, “in occasione della 58esima edizione del Congresso della American Society of Hematology, sono stati presentati i primi dati del nostro progetto CAR-CD44v6, raccolti da studi preclinici, che ne hanno confermato l’efficacia e la sicurezza nel trattamento dei tumori del sangue ma soprattutto ne hanno dimostrato la potenziale efficacia nei tumori solidi”.
“Il CAR-CD44v6”, sottolinea Palmisano, “rappresenta un prodotto con un potenziale terapeutico particolarmente elevato contro diverse neoplasie ematologiche, incluse leucemia mieloide acuta e mieloma multiplo, ma anche contro molti tumori epiteliali come i carcinomi della mammella, del colon, del pancreas, del polmone e di testa-collo”.
“I risultati preliminari sono estremamente incoraggianti e ci consentiranno di definire al meglio il percorso di sviluppo da seguire per avviare la sperimentazione nell’uomo”.
Un 2016 ricco di soddisfazioni: l’ottenimento di un finanziamento
“Sempre nel 2016” continua Palmisano “abbiamo avuto un altro eccellente risultato, ricevendo dalla Commissione Europea un finanziamento di quasi 6 milioni di Euro per il progetto EURE-CART (EURopean Endeavour for Chimeric Antigen Receptor Therapies). Tale progetto, di cui MolMed è coordinatore, ha come obiettivo principale una sperimentazione clinica multicentrica con CAR-CD44v6, la prima nell’uomo, finalizzata a dimostrare efficacia e sicurezza dell’immunoterapia basata sui linfociti CAR T CD44v6 nella leucemia mieloide acuta e nel mieloma multiplo”.
Un 2016 ricco di soddisfazioni: i servizi conto terzi
“Il 2016”, conclude sull’argomento, “è stato importante anche per il consolidamento dei cosiddetto secondo pilastro, quello dei servizi di sviluppo e produzione conto terzi ad alto valore aggiunto.
A marzo 2016 abbiamo infatti firmato un contratto di collaborazione per lo sviluppo e la produzione di una terapia genica per il trattamento del mieloma multiplo con Genenta Science, promettente start up italiana che opera nel settore delle terapie geniche e cellulari e che ha recentemente firmato un accordo strategico con l’americana Amgen per sviluppare una terapia innovativa contro il cancro. A settembre abbiamo ampliato il contratto di servizio già in essere con GSK, con un incremento sostanziale del fatturato minimo atteso nell’arco della durata del contratto, da 34 a 48 milioni di euro”.
Uno sguardo al 2017
Per il 2017 Palmisano sostiene che “se nel 2016 abbiamo raggiunto traguardi importanti, nel 2017 abbiamo il dovere di valorizzare questi risultati, a partire dal CMA di Zalmoxis, e di confermare quanto di buono fatto nello scorso anno” aggiunge “confermiamo che continueranno gli investimenti nelle attività̀ di ricerca e sviluppo e che consolideremo gli accordi di servizi di sviluppo e produzione conto terzi ad alto valore aggiunto”.
Innanzitutto “la società prevede la continuazione dello sviluppo clinico e industriale dei principali prodotti proprietari in sperimentazione e le attività propedeutiche all’accesso al mercato nei primi Paesi europei di Zalmoxis”.
Tutto ciò grazie anche alle prime interazioni dirette avute con il GB-A in Germania e la Commissione Tecnico Scientifica di AIFA in Italia. Inoltre, è stata estesa al 2030 l’esclusiva Certificato Complementare di Protezione (CCP) sul mercato italiano e sono stati siglati i primi accordi di licenza e distribuzione in Israele e in alcuni paesi asiatici.
Nell’anno in corso procedono le attività di sviluppo pre-clinico del progetto CAR CD44v6. “Nuovi studi pre-clinici condotti nel corso del primo trimestre 2017, ne hanno confermato il potenziale terapeutico nei tumori solidi umani”, ha sottolineato Palmisano “ma adesso dobbiamo concentrarci sulla definizione del profilo di sicurezza del prodotto. Alla luce dei risultati pre-clinici potrà essere definito il percorso per l’avvio della sperimentazione nell’uomo.
In relazione invece al consolidamento dei servizi conto terzi ad alto valore aggiunto Palmisano riporta che “a febbraio 2017 abbiamo formalizzato un primo accordo con la società americana Rocket Pharma per lo sviluppo e la produzione di una terapia genica per il trattamento dell’anemia di Fanconi”.
E prosegue, tornando sul versante dello sviluppo dei prodotti proprietari, “a fine aprile, MolMed e Megapharm hanno annunciato la firma di un contratto di distribuzione e licenza per la commercializzazione che definisce tutti i termini e le condizioni per la fornitura, registrazione, promozione e distribuzione di Zalmoxis in Israele, come previsto il 1° dicembre 2016, data in cui era stato siglato un term-sheet che ne definiva i principali contenuti, mentre il 30 giugno abbiamo siglato con TTY un contratto di licenza e distribuzione in esclusiva che definisce i termini e le condizioni per importazione, uso, commercializzazione, vendita e/o distribuzione di Zalmoxis nel trattamento di neoplasie ematologiche a Taiwan, Hong Kong, Singapore, Tailandia, Filippine, Vietnam e Malesia, come previsto nel term sheet firmato dalle due società il 7 febbraio scorso, in cui ne venivano definiti i contenuti principali.”
Si segnala, infine, che rimane forte “la nostra intenzione di individuare ulteriori nuovi partner industriali e finanziari, ivi inclusi partner interessati al co-sviluppo del nostro prodotto NGR hTNF, antitumorale con il quale sono stati ad oggi condotti studi clinici che hanno coinvolto più di 1000 pazienti; parallelamente contiamo di stipulare nuovi contratti di servizio in area cell&gene. Vorrei aggiungere, infine, che, in linea con l’evoluzione delle collaborazioni in essere e future, prevediamo la graduale attivazione della nuova facility di Bresso”.
I conti del primo trimestre 2017
Nel primo trimestre 2017 Molmed ha realizzato ricavi pari a 4,4 milioni, in calo del 17,5% rispetto al pari periodo 2016. Tale andamento è comunque linea con le previsioni della società e riflette la pianificazione delle attività così come predisposta da GlaxoSmithKline per questo periodo.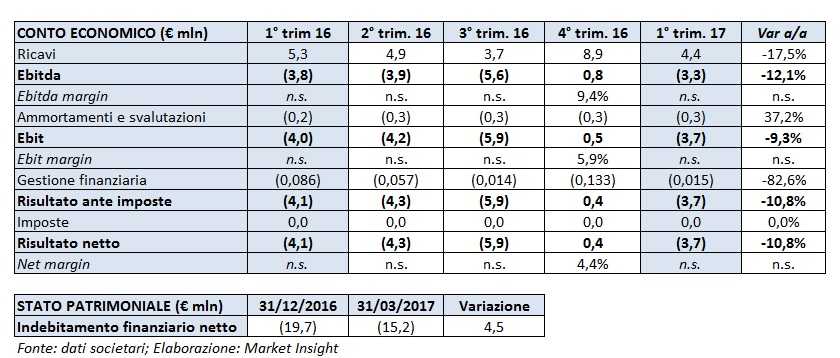
Nonostante il rallentamento del fatturato, nel primo trimestre si è ridotto il deficit a livello sia di Ebitda (-12,1% a 3,3 milioni) che di Ebit (-9,3% a 3,7 milioni), in presenza di ammortamenti e svalutazioni passati da 0,2 a 0,3 milioni.
Diminuita anche la perdita netta pari a 3,7 milioni (-10,8% a/a).
Dal lato patrimoniale la liquidità netta si è attestata a 15,2 milioni, in calo di 4,5 milioni rispetto a fine 2016.
Lo scenario dei prossimi 18-24 mesi
“Le caratteristiche del nostro core business”, spiega Palmisano,“non sono legate a dinamiche macroeconomiche particolari, di conseguenza non risentono delle variazioni subite da materie prime, tassi d’interesse o dinamica dei consumi”.
“Le variabili chiave per i prossimi 18-24 mesi”, prosegue il Ceo,“sono molto specifiche e riguardano l’esito delle negoziazioni con le autorità sanitarie nazionali per la definizione del prezzo/rimborso di Zalmoxis, la sigla di accordi per la commercializzazione dello stesso e l’avvio della sperimentazione clinica di CAR-CD44v6”.
Ricavi – Storico e prospettico in deciso progresso
Nelle tabelle che seguono viene presentato un confronto tra MolMed e il competitor Oxford BioMedica.
Si segnala che per il triennio 2014-2016 sono stati utilizzati i dati societari, mentre per il periodo 2017-2019 sono state impiegate le stime elaborate da Bloomberg.
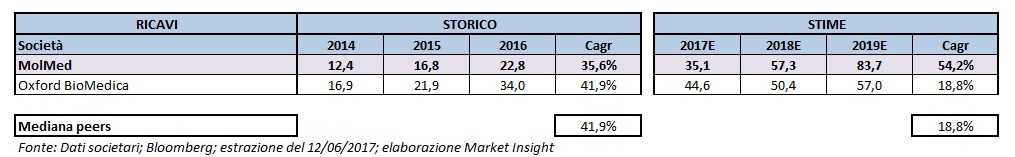
Dalla tabella sull’evoluzione dei ricavi si evidenzia come nel periodo 2014-2016 i ricavi della società siano passati da 12,4 milioni a 22,8 milioni con una crescita media annua del 35,6 per cento.
Una dinamica che risulta assolutamente positiva, pur essendo inferiore al +41,9% del competitor.
Il progresso di MolMed nel prospettico è previsto in deciso miglioramento al 54,2% e ben al di sopra del 18,8% di Oxford BioMedica.
Ebitda – Atteso un forte miglioramento
Dall’analisi dell’evoluzione storica dell’Ebitda si rileva che MolMed ha aumentato lievemente il deficit mentre Oxford BioMedical ha ridotto dell’11 per cento.
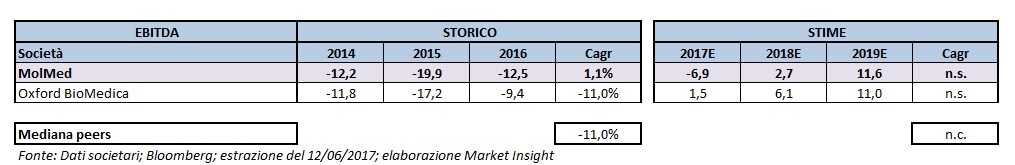
Osservando i dati prospettici si osserva che MolMed dovrebbe ridurre ulteriormente il deficit quest’anno per poi passare a un valore positivo a partire dal prossimo anno a 2,7 milioni e salire ulteriormente fino a 11,6 milioni nel 2019.
Oxford BioMedica dovrebbe invece attestarsi a un valore positivo a partire già da quest’anno fino a raggiungere gli 11 milioni di fine biennio.
Ebit – Atteso in progresso in scia agli altri aggregati
Una dinamica abbastanza simile si rileva anche a livello di risultato operativo.
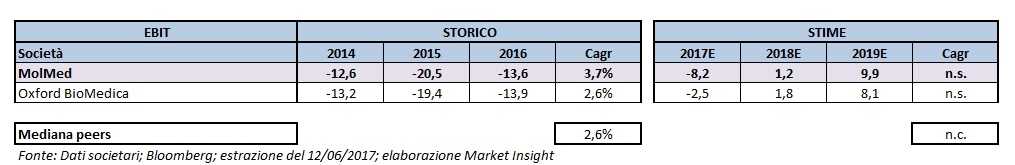 Nel dettaglio nel periodo 2014-2016 le società riportano un aumento medio del deficit rispettivamente del 3,7% a 13,6 milioni e del 2,6% a 13,9 milioni.
Nel dettaglio nel periodo 2014-2016 le società riportano un aumento medio del deficit rispettivamente del 3,7% a 13,6 milioni e del 2,6% a 13,9 milioni.
Un andamento che migliora decisamente nel prospettico in quanto sia MolMed che Oxford BioMedica dovrebbero passare quest’anno a -8,2 milioni e -2,5 milioni, per poi raggiungere un valore positivo a partire dal prossimo anno e proseguire lungo tale trend rispettivamente fino a 9,9 milioni e 8,1 milioni nel 2019.
Analisti
Banca Imi conferma il buy con target a 0,88 euro alla luce degli importanti traguardi raggiunti nel 2016 e nel primo trimestre 2017.
Borsa – L’ottima performance riflette l’apprezzamento dei traguardi raggiunti
Il titolo MolMed ha chiuso la seduta di ieri con un ribasso dello 0,7%, portandosi a 0,42 euro.
Nelle ultime 52 settimane l’azione ha segnato un +22%, sostanzialmente in linea con il relativo indice settoriale Ftse Italia Salute.
Un trend ascendente sostenuto da un primo trimestre 2017 contraddistinto dal raggiungimento di importanti traguardi, tra cui accordi di licenza e distribuzione in Israele e in alcuni paesi asiatici.
Il tutto in scia ai rilevanti risultati raggiunti nel corso del 2016, primo tra tutti l’Autorizzazione della Commissione Europea all’immissione condizionata in commercio (CMA) di Zalmoxis®.
Non meno importanti, inoltre, il finanziamento di circa 6 milioni di euro per il progetto EURE-CART (EURopean Endeavour for Chimeric Antigen Receptor Therapies), di cui MolMed è coordinatore, e la presentazione dei primi dati pre-clinici del progetto CAR-CD44v6.
Criticità
MolMed, realtà focalizzata su ricerca, sviluppo, validazione clinica e produzione di innovative terapie geniche e cellulari, è inevitabilmente esposta alle dinamiche e ai rischi che caratterizzano tale ambito. Di seguito se ne segnalano alcuni.
Un primo fattore di rischio è rappresentato dalla possibilità che i propri prodotti, ancora in fase di sperimentazione clinica, si dimostrino inefficaci o causino effetti collaterali e non ricevano quindi le necessarie autorizzazioni da parte delle autorità competenti o non le ottengano nei tempi adeguati per la commercializzazione.
Altro elemento di criticità è rappresentato dall’elevato grado di concorrenza che normalmente caratterizza il mercato delle biotecnologie e dei prodotti farmaceutici, in particolare in ambito oncologico. In tale segmento MolMed deve essere perciò in grado fronteggiare realtà spesso di maggiori dimensioni, che possono contare su economie di scala e su rilevanti risorse finanziarie.
Esistono poi rischi legati ai contratti di licenza e fornitura. Infatti, MolMed sigla contratti di licenza con diverse realtà per l’acquisizione di diritti su tecnologie e processi produttivi e contratti di fornitura, ad esempio per l’acquisto del materiale necessario. La società potrebbe non essere più in grado di mantenere le attuali condizioni contrattuali e/o siglare nuovi contratti adeguati.
Infine, ma non meno importante, il rischio legato al finanziamento delle attività di ricerca e sviluppo. Infatti la società, che si trova nella fase di sviluppo di nuovi prodotti e che sostiene elevati costi di ricerca, potrebbe non essere in grado di reperire adeguate risorse finanziarie necessarie per la propria operatività.





























